包括干细胞在内的细胞**产品具有很高的临床潜力,全球干细胞市场包括上中游的干细胞存储制备以及下游的临床应用。
为了使细胞**产品成功应用,细胞的长期低温存储是必须攻克的技术难点,因为低温保存是长期保存细胞活力和生化功能的**可用方法。为了避免细胞内结冰对细胞结构的损害,一些生物制剂冻干保护剂,冷冻保护剂已经上市。*常用的生物制剂冻干保护剂,冷冻保护剂是二甲基亚砜(DMSO)与胎牛血清或血清替代品联合使用。
然而,胎牛血清含有异种动物源蛋白,可能会引起未知病原体的人畜共患**。此外,DMSO具有细胞毒性。据报道,DMSO对组织和细胞的毒性取决于暴露时间、温度和浓度。毒性程度因细胞类型而异,在未去除DMSO的情况下再次注入解冻细胞的患者中有不良反应的报道。此外,已知DMSO会通过调节三种DNA甲基转移酶(Dnmts)的转录水平和改变全基因组甲基化谱来影响小鼠胚状体的表观基因组,进而导致小鼠干细胞的不受控分化。因此二甲基亚砜+胎牛血清并不适合临床使用,急需开发高效无毒的生物制剂冻干保护剂,细胞冷冻保护剂。
海藻糖生物制剂冻干保护剂是一种非还原性双糖,存在于多种能够在完全脱水状态下存活的生物中,如细菌、酵母、缓步动物和线虫。哺乳动物不产生海藻糖,但海藻糖确实是一种有效的冷冻保护剂,可以减少冰晶形成造成的细胞损伤。其保护作用既与渗透效应有关,也与细胞膜磷脂和不稳定蛋白的特异性相互作用有关,可防止其因干燥和氧化应激而损伤和变性。
海藻糖生物制剂冻干保护剂不具有细胞毒性,已被有效地用于小鼠精细胞、成人造血干细胞,间质干细胞,脂肪来源干细胞,人类胚胎干细胞(hESCs) 和人类诱导多能干细胞(hiPSCs) 等不同细胞类型的冷冻储存。此外,海藻糖生物制剂冻干保护剂还用于脐带血、骨髓、人类移植表肝细胞和人类胰岛的冷冻储存。
阻止海藻糖在细胞保存中广泛应用的主要障碍是其难以进入细胞内部。以前已经应用了几种方法,如渗透休克、脂质体递送、热穿孔、电穿孔、微量注射和基因工程等方式来帮助海藻糖进入细胞内部。然而,上述方法需要非常繁琐的操作,费力耗时,且可能导致**的细胞损伤。
该研究探究了在没有二甲基亚砜及胎牛血清的情况下,使用海藻糖单独或与乙二醇(乙二醇)或甘油(甘油)联合,配制了4种不同的海藻糖复合型冷冻保护剂,低温保存3种不同类型的多能干细胞系并复苏,对几个关键参数进行了**研究,包括细胞形态、解冻后生存能力、多能性标记物表达水平、基因组稳定性、内质网(ER)稳态、DNA损伤反应等,以衡量不同海藻糖复合型冷冻保护剂对多能干细胞的低温保护能力。
1. 不同冷冻保护剂组成
|
组别 |
成分 |
|
A |
0.5M 海藻糖 |
|
B |
0.5M 海藻糖+2.5% 乙二醇 |
|
C |
0.5M 海藻糖+10% 乙二醇 |
|
D |
0.5M 海藻糖+10% 甘油 |
所有冷冻保护剂均现用现配,使用磷酸盐缓冲液(PBS)稀释。实验中用到的细胞均使用CS10冷冻保存。CS10是一种无血清,无动物源成分,含有10% DMSO,推荐用于人类多能干细胞(hPSCs)的冷冻保护剂。
2. 细胞的冷冻保存及解冻
细胞在特定条件下培养,用0.5 mM EDTA解离hESCs RC17,用细胞消化液解离hiPSCs CTR2#6和AF22,并在新鲜制备的冷冻保护剂(A,B,C和D)中处理。2.0×10^6细胞在每种冷冻保护剂1.5 mL中重悬,然后转移到低温小瓶中。
低温小瓶使用冷冻容器进行冷却,该容器冷却速率约为-1°C/min,放置过夜后,转移到- 80°C冰箱。再24小时后,将低温小瓶转移到液氮中,并在分析前存储至少一周。
解冻时,取出低温小瓶,37°C水浴加热直至冰团消失,细胞悬液用温暖的培养基稀释。以200g离心3分钟收集细胞,并以指定的接种量将其接种到适合每种细胞类型的包被培养容器上。
3. 结果与讨论
①细胞活力
解冻48?h后,用阿拉玛蓝法测定细胞活力。
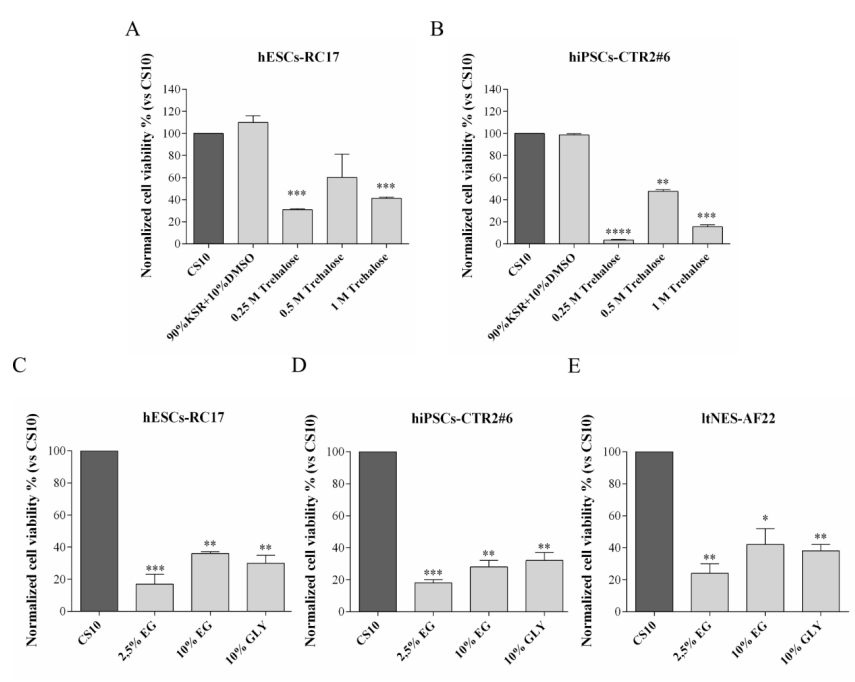
首先,为了确定海藻糖、乙二醇、甘油单独使用时的适宜用量。在不同干细胞系中分别使用不同浓度的单组分溶液,测试细胞复苏后的活力并与对照组进行比对。结果表明0.5M 海藻糖,10%乙二醇和10%甘油是较为适宜的浓度,但在不同的干细胞类型之间存在很大的差异。
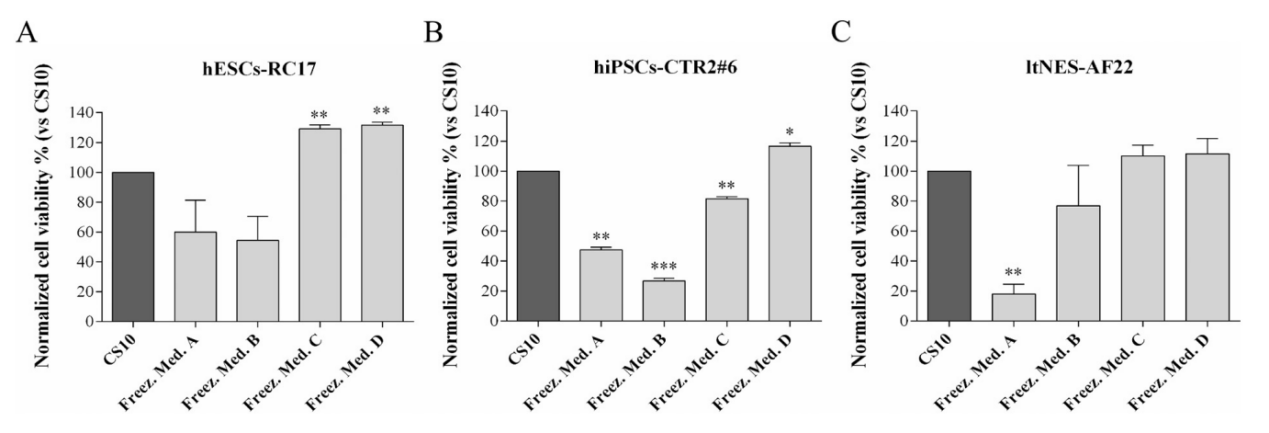
确定初始浓度后,选定4种冷冻保护剂配方(详见上文),对三种干细胞系(A) hESCs-RC17, (B) hiPSCs-CTR2#6和(C) ltNES-AF22进行冷冻保存及复苏,进行细胞冷冻复苏后活力检测。并将细胞存活率与在CS10中冷冻保存的相同细胞在相同条件下进行比较。
当细胞*用海藻糖(冷冻保护剂A组)冷冻保存时,解冻后的细胞恢复率降低,不同干细胞类型的细胞恢复率从20%到60%不等。
在以海藻糖为基础的培养基中添加10% 乙二醇或甘油时(冷冻保护剂C组、D组),RC17和AF22细胞的细胞存活率都达到了与DMSO相似的水平,而在CTR2#6中,甘油的细胞存活率优于乙二醇。
此外,对比*由乙二醇或甘油组成的对照冷冻溶液的实验结果,可以确认细胞存活率的增加是乙二醇/甘油+海藻糖联合作用的结果。
这些结果表明,海藻糖可以有效地用于人类多能干细胞的冷冻保存,有望替代DMSO,添加10% 乙二醇或甘油可**提高海藻糖冷冻保护剂的存活率。与对照组CS10相比,细胞平均存活率增加。乙二醇/甘油+海藻糖组成的冷冻保护剂不含血清蛋白,避免了先前报道的刺激多能干细胞过早分化的风险。
②细胞形态
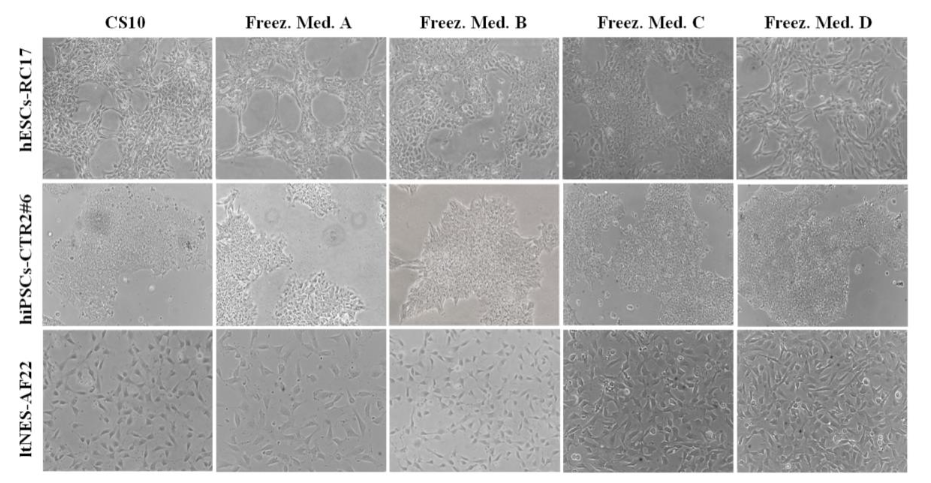
干细胞冻存另一个重点关注的问题是染色体和多能性改变。冷冻和解冻过程可能在细胞内外形成冰晶和气泡,破坏纺锤体微管进而诱导染色体异常分离,导致细胞生长特征和形态变化。因此,可通过观察冻存复苏后的细胞形态来较为直观地评估干细胞染色体及多能潜力受到损害的可能性。
上图显示了解冻48小时后RC17、CTR2#6和AF22的细胞形态。相位对比图像证实,在所有细胞系中,海藻糖复合冷冻保护剂均未引起明显的形态变化,细胞形态与CS10中保存的细胞相同。
③标志物表达水平
为了确认冻存复苏后的RC17、hiPSCs CTR2#6和AF22保留了多能干细胞的关键性质和特征,在解冻48 h后通过定量RT-PCR分析几个标记物的表达水平。
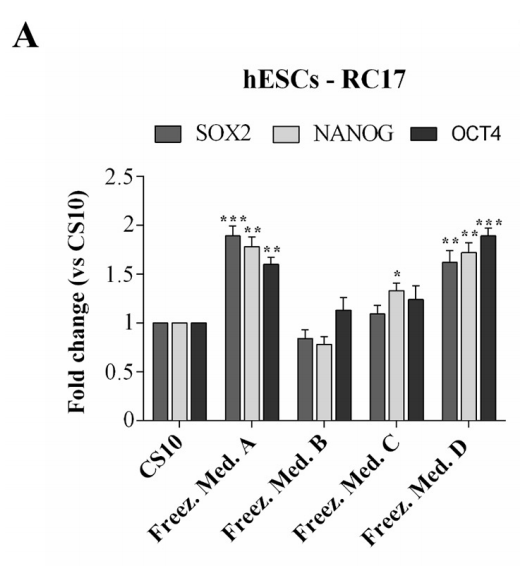
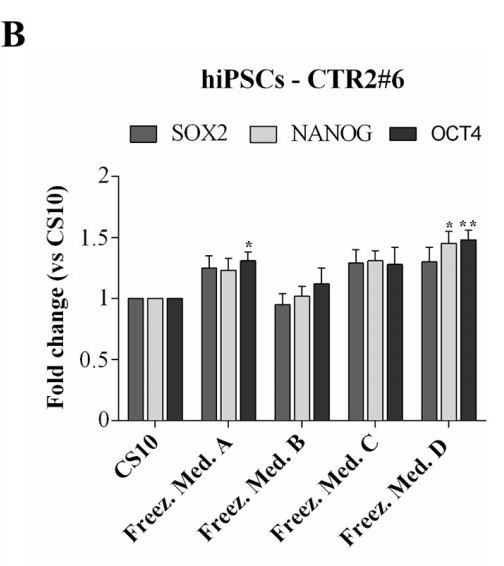
对RC17和CTR2#6细胞检测细胞标记Nanog, Oct4和Sox2。与对照组进行比对。
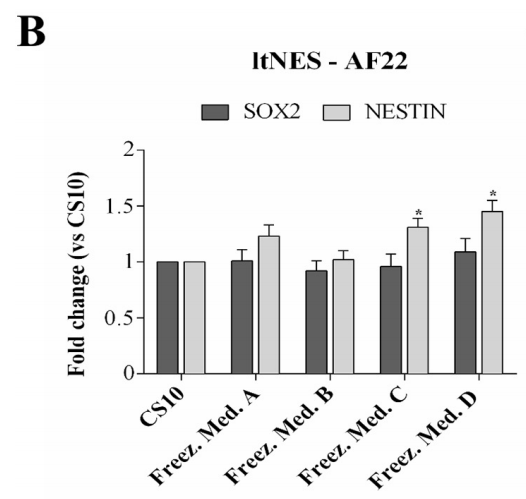
对AF22细胞检测细胞标记Nestin和Sox2。与对照组进行比对。结果显示干细胞分化潜能未受影响。
④染色体稳定性
为了评估海藻糖冷冻保护剂对干细胞染色体稳定性的影响,对所有三种干细胞系进行常规核型分型和aCGH,下图为AF22细胞系储存前后的结果。
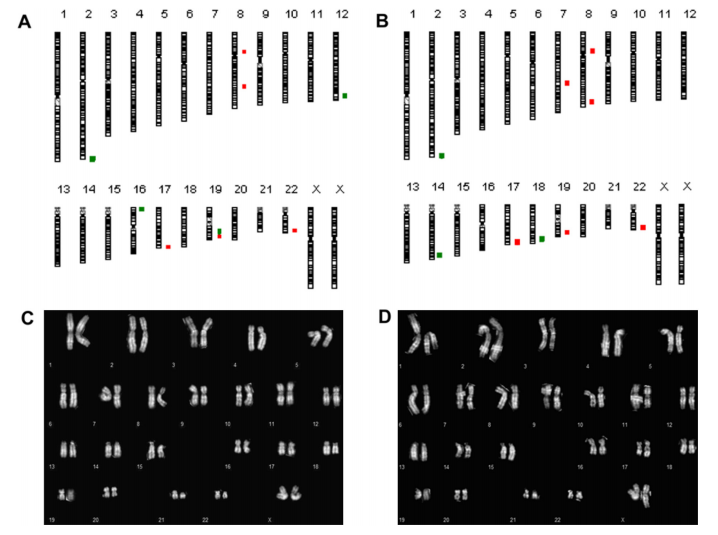
总体而言核型保持稳定,但检测到少量CNVs(染色体2、8、19和22),其中一些可能已经存在于原始细胞群中,另一些可能是在细胞体外操作过程中随机产生的,而不是冷冻保存导致,因为在储存前(图C)和储存后(图D)均未观察到克隆非整倍体或结构染色体畸变。
⑤内质网应激/未折叠蛋白水平评估
该研究还关注了在CS10或海藻糖中低温保存是否会对多能细胞响应内质网应激和**UPR通路的能力产生负面影响。为了在不同的生理或病理状态下维持稳态,ER整合了各种分子和细胞信号。内质网应激和UPR都介导影响细胞增殖、分化和凋亡的分子和生化机制。
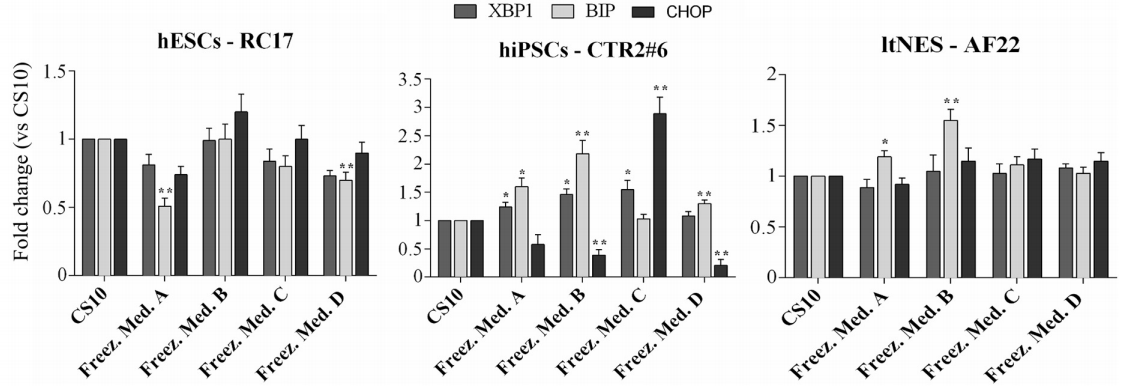
总体而言,与对照组CS10相比,内质网应激/UPR反应水平适中。**一种更敏感的细胞系是CTR2#6,在实验组B和C中显示出更高水平的BIP和CHOP水平。表明与CS10相比,海藻糖低温保存不会明显改变多能干细胞内质网(ER)稳态。
海藻糖(供注射用)(无菌)
1、产品名:海藻糖(供注射用)(无菌)
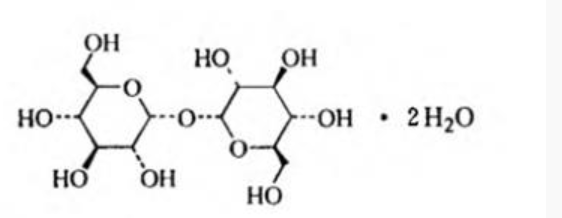
2、中文名称:D(+)-海藻糖二水合物
3、英文名称:D(+)-Trehalose dihydrate (for injection)
4、化学名称:α-D-吡喃葡萄糖基-α-D-吡喃葡糖苷二水合物
5、型号:Hipo-S
6、含量测定:99.3%
7、CAS号:6138-23-4
8、EINECS登录号:202-739-6
9、备案登记号:F20190000452
10、DMF号:034401
11、质量标准:符合各国药典标准(Chp,USP,JP,EP)
12、分子式:C12H22O11·2H2O
13、分子量:378.33
14、性状:白色结晶性粉末
15、比旋度:+198.8°
16、酸度:6.0
17、氯化物:符合规定
18、硫酸盐:符合规定
19、可溶性淀粉:符合规定
20、炽灼残渣:0.04%
21、重金属:符合规定
22、水分:9.5%
23、有关物质:总杂0.06%,葡萄糖未检出,麦芽三糖0.06%,**未知单杂未检出
24、无菌:符合规定
25、微生物限度:无菌
26、细菌内:<0.1IU/g
27、氮:符合规定
28、含量测定:99.3%
29、溶解性:易溶于水,溶于热乙醇,微溶于甲醇,不溶于**、**
30、保存:密封、凉暗干燥处保存,常温条件下运输。
31、货号:008001
32、结构式:
AVT竭诚为您服务,欢迎惠顾!400-6262-623,AVT-avt.com