纳米药物是设计更好的药物递送系统(DDS)的一种有前景的方法,而基于细胞/组织的脂质载体的开发是一种有前景的策略。在本研究中,作者提出了重组脂质纳米颗粒(rLNPs)的概念,并提供了一种简单的制备方法。结果表明,从细胞(小鼠乳腺癌症细胞系,4T1)和组织(小鼠肝组织)中制备超小(~20nm)rLNP高度可再生。作为一个选定的模型平台,来源于小鼠肝组织的rLNP可以进一步用成像分子(吲哚菁绿和香豆素6)标记,并用靶向配体(生物素)修饰。此外,rLNPs被证明具有高度的生物相容性,能够负载各种药物,如盐酸阿霉素(Dox)和姜黄素(Cur)。最重要的是,Dox负载的rLNPs(rLNP/Dox)在体外和体内都表现出良好的抗癌性能。因此,rLNPs可能是构建不同DDS和治疗多种疾病的潜在多功能载体。
材料:
盐酸阿霉素Dox、姜黄素(Cur)、香豆素(C6)、吲哚菁绿(IGG)、甲基噻唑四氮唑(MTT)。DSPE-PEG2000-Biotin(艾伟拓(上海)医药科技有限公司),其他没有具体说明的化学品和试剂都是从阿拉丁购买,并且是分析级的。
艾伟拓AVT在售的DSPE-PEG2000-Biotin来自日本丘比的蛋黄卵磷脂,并且是以蛋黄粉为原料通过先进工艺提取、纯化的磷脂混合物。
选择好的磷脂产品可以来艾伟拓(上海)医药科技有限公司看一看,这是一家专营磷脂类高端药用辅料的科技公司,公司旗下产品丰富,有着技术专家的专业支持,能够及时的解决客户问题,助力客户价值的提升。
rLNPs的制备:
遵循先前报道的方案,从细胞和组织中提取全脂,并进行修饰。简而言之,将100 mg的新鲜组织(或5x107的细胞)切成片,装入500 μL 含有75%甲醇的玻璃均质器中。在0℃下研磨约50次后,将混合物转移到含有另1 mL甲基叔丁基醚(MTBE)的棕色试管中,将试管放入摇床中1小时,以便充分提取脂质,然后,向管中加入250 μL纯水,静置10min进行相分离,然后在0℃下,15000xg离心15min,将含有浓缩脂质的上部MTBE相转移到另一个新的棕色试管中,并使用吹氮仪器进行干燥。
将得到的脂质溶解在乙醇中,达到指定的浓度。然后,根据文献作者之前的研究,采用溶剂扩散法,将乙醇溶液在搅拌(500rpm),以0.1 mL/s的恒定速率,通过注射器注入纯水(体积比为:1:9)。
关于材料和方法的所有详细信息请参考support information。
结果:
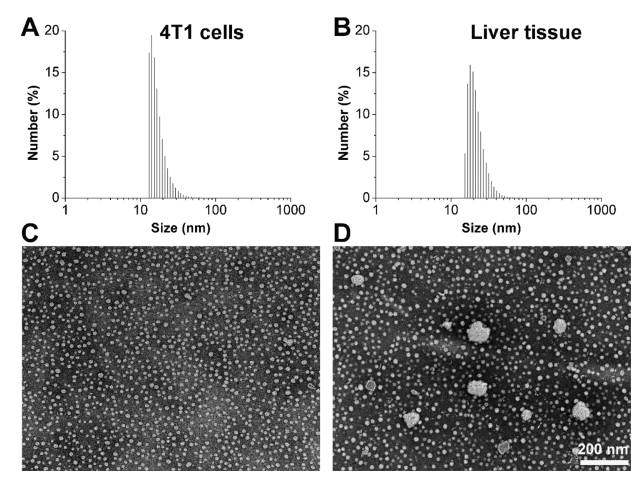
图1:使用从4T1细胞和小鼠肝组织提取的脂质制备的rLNP的尺寸分布(A,B)和形态观察(C,D)。比例尺:200 nm。
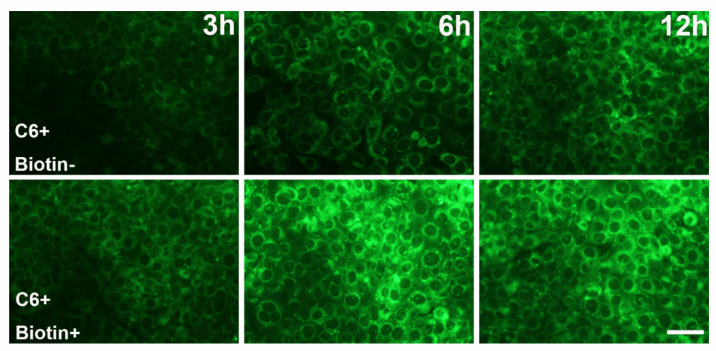
图2:4T1细胞中,未修饰(上)和生物素修饰(下)的C6标记rLNP的时间依赖性细胞摄取谱。比例尺:50μm
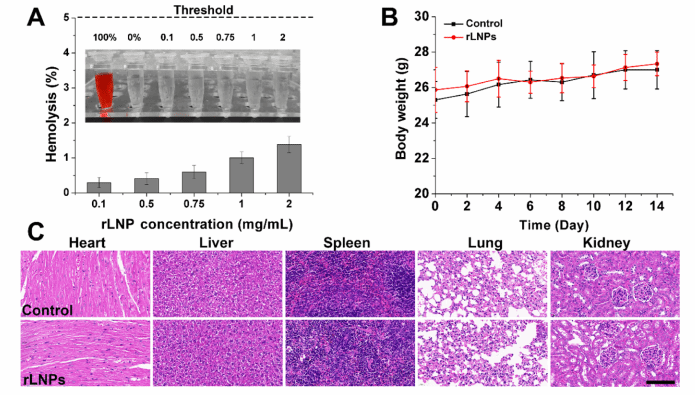
图3:rLNPs的生物相容性测定。(A)用不同浓度的rLNP处理1小时后2%红细胞的溶血。插入的图像显示不同组的上清液。(B)小鼠的体重变化每隔一天静脉注射rLNPs(100mg/kg),持续14天。数据显示为三个独立结果的平均值和标准差。(C)从给药结束时从受体获得的主要器官制备的HE组织病理学切片。比例尺:100μm。
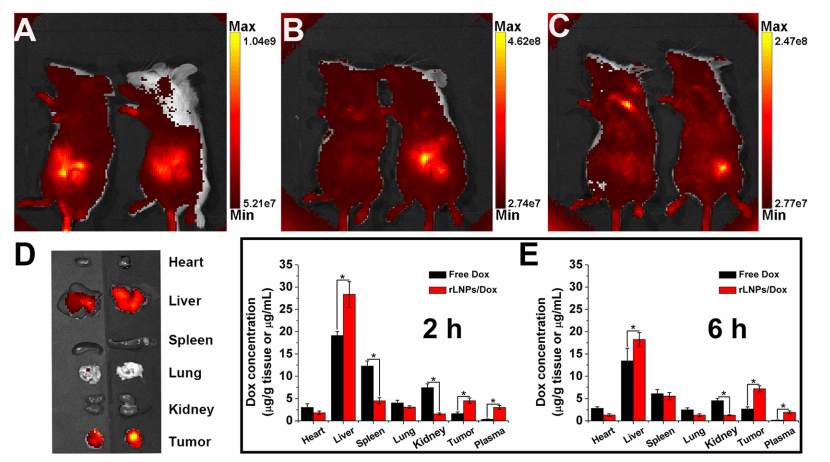
图4:rLNPs的体内肿瘤积聚测定。将游离ICG(左)和ICG标记的rLNP(右)静脉注射到原位4T1荷瘤小鼠中,并通过实时成像观察受试者在6(A)、24(B)和48小时(C)时的ICG信号分布。在注射后48小时,切除一名受试者的主要器官和肿瘤组织进行离体成像(D)。(E) 静脉内给予游离Dox和rLNP/Dox(Dox剂量:5mg/kg)后4T1荷瘤小鼠的时间依赖性组织/血浆Dox浓度。Dox浓度分别表示为组织的μg/g组织和血浆的μg/mL。数据显示为三个独立结果的平均值和标准差*P<0.05
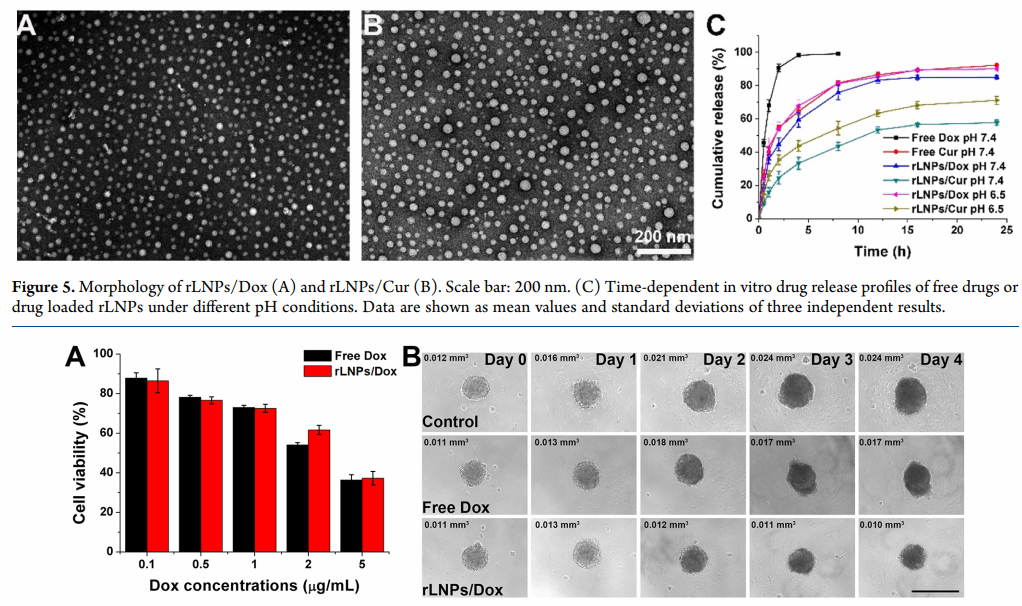
图6:rLNP/Dox的体外抗癌性能。(A) 孵育24小时后,游离Dox和rLNP/Dox对4T1细胞的浓度依赖性细胞毒性。数据显示为三个独立结果的平均值和标准差。(B) MCTS与游离Dox或rLNP/Dox(Dox浓度:1μg/mL)孵育4天后的图像。比例尺:500μm。左侧的定量结果表示MCTS的相应体积
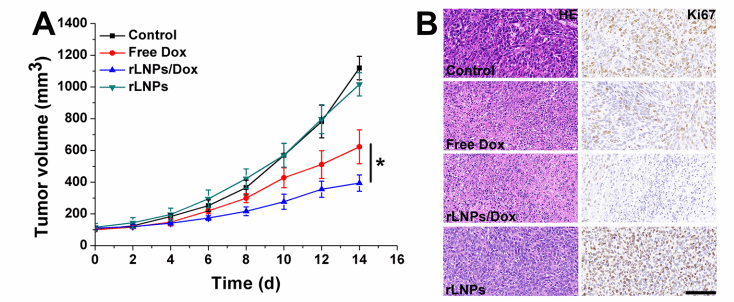
图7:rLNP/Dox的体内抗癌性能。(A) 肿瘤体积变化和(B)HE和Ki67染色后的离体肿瘤切片的代表性图像。比例尺:100μm*P<0.05。
总之,在本研究中,作者提出了rLNPs的概念和制备方法,并展示了其作为多功能药物递送载体的潜力。它们的优点包括:(1)从细胞和组织制备的重复性高;(2) 用荧光分子进行柔性标记,并对靶向配体和可能的其他功能部分进行修饰;(3) 高生物相容性;(4) 能够装载各种分子/药物;以及(5)作为药物载体具有良好的体外和体内抗癌性能,这可以通过负载其他种类的药物进一步扩展到治疗其他疾病。在未来的工作中,作者将重点关注以下几个方面:(1)将rLNPs的应用扩展到不同的药物和其他疾病模型;(2) 探讨rLNPs是否具有细胞/组织特异性功能;和(3)阐明是否可以使用rLNP实现细胞/组织训练,因为它们包含母体细胞/组织的脂质组学。